Результаты лечения геморроя методом деструкции геморроидальных узлов с помощью диодного лазера
Черепенин М.Ю., Горский В.А., Армашов В.П.
ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, г. Москва, Россия (ректор – академик РАН, профессор С.А. Лукьянов)
ВВЕДЕНИЕ
Методики лечения геморроидальной болезни с применением лазерных технологий от года к году приобретают все большую популярность. Это связано с выявлением новых эффектов лазерного излучения, возникающих при изменении конструкции приборов или параметров их работы [1,2].
Наибольшая часть публикаций 80-90-х годов прошлого века была посвящена открытому использованию, в основном, СО2-лазеров для иссечения или вапоризации измененной ткани геморроидальных узлов [3].
Приборы, применяемые для этих целей, помимо того, что были достаточно громоздкие и дорогие, отличались малым диапазоном длины волн. Внедрение в эксплуатацию в 90-х годах диодных высокоэнергетических лазеров позволило существенно расширить диапазон длины волн, повысить надежность и безопасность приборов, снизить их стоимость [4].
Излучение современных лазеров вызывает, в первую очередь, термический эффект. Это происходит за счет поглощения квантов света с трансформацией световой энергии в тепловую. При этом на малой площади возникает чрезвычайно высокая температура. В результате происходит моментальное испарение тканевой жидкости с развитием коагуляционного некроза тканей. Воздействие лазерного излучения на ткани определяется такими параметрами, как плотность его мощности и степень фокусирования луча. К тому же оно зависит от содержания в облучаемых тканях воды и пигмента [5,6].
При температуре от 40 до 53 °С отмечается слабая и частично обратимая реакция в виде нарушения белковых связей с денатурацией и расплавлением коллагена. При этом связи проколлагеновых цепей белковых молекул не разрушаются. При прекращении воздействия излучения, как правило, молекулы восстанавливаются, хотя и происходит некоторое переустройство матрикса [7].
Повышение температуры в тканях более 53 °С приводит к их необратимым повреждениям. При температуре 63 °С все белковые структуры претерпевают деградацию. Этот процесс сопровождается их контракцией, происходит уплотнение и уменьшение в объеме основного вещества. При прекращение лазерного воздействия обратного развития повреждения и полного восстановления клеточных структур уже не происходит.
Увеличение температуры в тканях, подвергающихся лазерному воздействию более 90 °С, приводит к вапоризации (эффекту испарения ткани).
Возникает мгновенное закипание жидкости с разрывом и разрушением клеток. В зоне воздействия выявляется коагуляционный некроз, а в окружающих тканях – отек, сосудистые расстройства и кровоизлияния. При повышении температуры в тканях до 150 °С и более происходит карбонизация тканей с полным нарушением морфологической структуры [7]. Коагуляция крови в сосудах полностью исключает возможность кровотечения.
Еще одним важным свойством высокоинтенсивного лазерного излучения является выраженное бактерицидное действие, значительно снижающее вероятность развития септического воспаления. Слабая экссудация из микроциркуляторного русла и малая продукция медиаторов воспаления из коагулированных тканей препятствуют лейкоцитарной инфильтрации. Отсутствие выраженного отека и воспаления в тканях обусловливают раннюю пролиферацию фибробластов и макрофагов, что, в свою очередь, способствует синтезу коллагена и кейлонов, ответственных за регенерацию тканей [5]. Раны заживают по типу первичного натяжения без грубых рубцовых образований, что является приоритетным при проведении оперативных вмешательств в зоне промежности.
Лазерные установки активно применяются для лечения геморроидальной болезни [1,8,9]. В некоторых работах сравнивается их эффективность с традиционным хирургическим лечением (операция Миллигана-Моргана) и степплерной геморроидопексией [2,6]. Общим является то, что при использовании лазерных технологий уменьшается количество осложнений и повышается качество уровня жизни в послеоперационном периоде.
В зависимости от методики, используются «водоспецифичные» или «гемоглобиновые» режимы лазерного излучения. Излучение видимой части спектра (с длиной волны от 0,40 до 0,70 мкм) избирательно поглощается такими пигментными субстанциями, как гемоглобин, миоглобин, меланин. Инфракрасное излучение (с длиной волны от 0,70 до 1,40 мкм) в основном поглощается клеточными белками. Оно наиболее глубоко проникает в ткани. Также установлено, что для длины волны 0,81 мкм хромофором-мишенью является оксигемоглобин. Подобное излучение характеризуется высоким поглощением в гемоглобине крови и низким поглощением в окружающей жидкой среде. Подобные лазеры в настоящее время относят к «гемоглобинпоглащаемым» лазерным системам (Н-лазеры) [7]. Именно они до последнего времени широко использовались для лечения заболеваний аноректальной зоны [2,4,8,10].
Излучение с длиной волны 1,32 мкм поглощается как в оксигемоглобине, так и в воде. Однако, поглощение в оксигемоглобине преобладает над поглощением в воде. У лазеров с длинами волн ближе к 1,5 мкм поглощение в воде уже будет преобладающим. Лазерные аппараты с длиной волны от 1,47 до 1,56 мкм (W-лазеры) уже воздействуют так называемым «водопоглощаемым» или «водо-специфичным» видом лазерного излучения [7,9,11]. А практически полностью молекулами воды поглощается инфракрасное излучение с длиной волны более 10,6 мкм. Его воздействие распространяется только на верхние слои тканей.
При лечении геморроидальной болезни в доступных литературных источниках описаны совершенно разные режимы и мощности используемого излучения [11,12]. Это свидетельствует о том, что до настоящего момента методики не стандартизированы и требуется проведение дальнейших исследований. По нашему мнению, более обоснованным при выполнении субмукозной лазерной деструкции геморроидальных узлов будет применение лазерного излучения в «водопоглощаемом» диапазоне.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить результаты субмукозной лазерной деструкции геморроидальных узлов с использованием «водоспецифичного» лазера при лечении пациентов с хроническим геморроем.
ПАЦИЕНТЫ И МЕТОДЫ
С сентября 2017 по январь 2019 года с использованием методики субмукозной лазерной деструкции геморроидальных узлов оперировано 124 пациентов с хроническим геморроем. В исследование было включено 68 (54,8%) женщин и 55 (45,2%) мужчин. Возраст больных варьировал от 31 до 78 лет. Длительность заболевания составляла от 6 месяцев до 25 лет.
По стадиям заболевания пациенты распределились в следующих пропорциях: хронический геморрой II стадии – 64 (51,6%) пациента, III стадии – 44 (35,5%), IV стадии – 16 (12,9%) человек. Показаниями к оперативному лечению являлись рецидивные анальные кровотечения (у 74 пациентов), выпадение геморроидальных узлов (у 67), рецидивирующие перианальные тромбозы (у 33), эстетический дискомфорт (у 41). У ряда пациентов имели место сразу несколько патологических факторов. Характеристика пациентов представлена в таблице 1.
Таблица 1. Распределение пациентов по стадиям хронического геморроя и показания к операции
Table 1. Stages of the hemorrhoids and indications for surgery
| Показания к операции | II стадия (n=64) |
III стадия (n=44) |
IV стадия (n=16) |
Все пациенты n=124) |
||||
| Муж. | Жен. | Муж. | Жен. | Муж. | Жен. | Абс. | % | |
| Рецидивные анальные кровотечения | 21 | 9 | 18 | 14 | 8 | 4 | 74 | 59,7 |
| Выпадение геморроидальных узлов | 7 | 2 | 18 | 24 | 10 | 6 | 67 | 54,0 |
| Рецидивирующие перианальные тромбозы | 5 | 8 | 6 | 13 | 1 | - | 33 | 26,6 |
| Эстетический дискомфорт | 7 | 23 | 2 | 7 | - | 2 | 41 | 33,1 |
Лечение проводилось в условиях стационара. Все пациенты перед оперативным лечением были комплексно обследованы. Определялись лабораторные показатели, выполнялась рентгенография легких, ЭКГ, колоноскопия, проводилась консультация терапевта.
Методика субмукозной деструкции геморроидальных узлов
Операции выполнялись под спинномозговой или тотальной внутривенной анестезией. Выбор вида анестезии зависел от соматического статуса пациента, наличия сопутствующей патологии и объема планируемого оперативного вмешательства. Первым этапом лигатурой Викрил 2/0 восьмиобразным швом на 2-3 см выше зубчатой линии производились прошивание и перевязка геморроидальной артерии. Вторым этапом выполнялось подслизистое введение под геморроидальный узел 0,5-0,8 мл раствора местного анестетика (Ultracain D-S 1:200000). Третьим этапом торцевой световод в активном режиме пункционно трансдермально вводился в подслизистый слой под геморроидальным узлом. Далее субмукозно проводился до основания геморроидального узла (визуализация пилотного луча) и места перевязки геморроидальной артерии. После этого выполнялась субмукозная вапоризация до видимой глазом редукции геморроидальной ткани и появления очагов «белой» денатурации (Рис. 1).
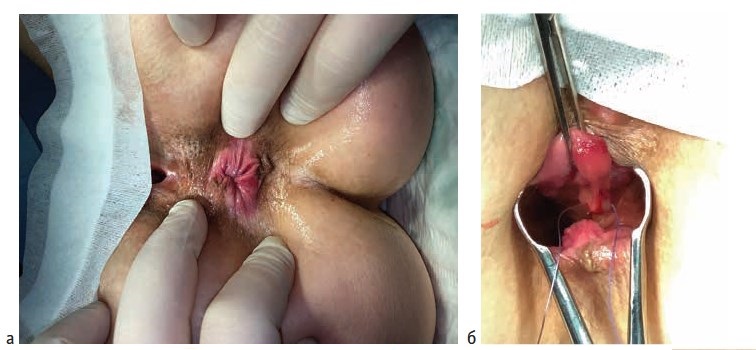
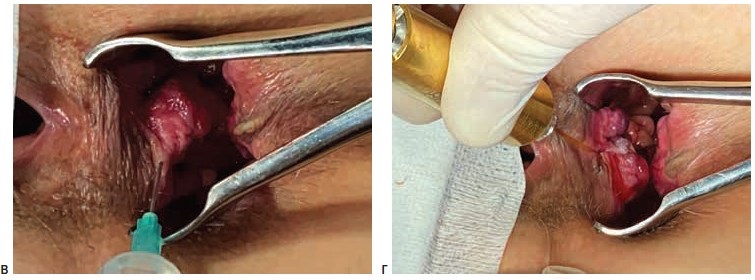
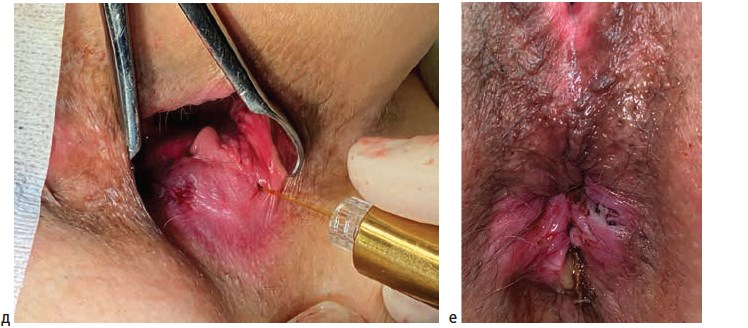
Деструкция геморроидального узла выполнялась с помощью торцевого световода на лазерной установке «Mediola Compact» (ЗАО Фотек, Республика Беларусь). Прибор работал в водоспецифическом диапазоне (W-диапазоне) с длиной волны 1,56 мкм, использовалась мощность 12 Вт и импульсный режим 0,5 сек/0,5 сек. У пациентов с III и IV стадиями геморроя после лазерной деструкции геморроидальных узлов, результатом которой являлось уменьшение их размеров в 2-3 раза, выполнялось иссечение избытка перианальной дермы над зоной лазерной деструкции с помощью биполярной коагуляции с использованием аппарата «LigaSure» (Valleylab, США).
В условиях стационара в большинстве случаев пациенты находились от 7 до 10 часов, после чего отпускались под динамическое наблюдение оперирующим хирургом. После операции назначались нестероидные противовоспалительные средства, гемостатики, растительные слабительные препараты, мази для местного применения. Дополнительно разъяснялись правила гигиены и ухода за послеоперационной раной.
Оценивали время продолжительности операции, выраженность болевого синдрома по визуальной аналоговой шкале (ВАШ), длительность приема аналгетиков, время разрешения отека в перианальной зоне, наличие или отсутствие анального кровотечения, время нахождения пациента в стационаре, длительность периода нетрудоспособности.
При выписке из стационара пациентам на руки выдавалась анкета для отражения динамики послеоперационного периода. Заполненная анкета при последней явке на прием возвращалась оперирующему хирургу. В пределах трехнедельного периода пациенты оценивали разницу качества жизни до и после операции, динамику интенсивности болевого синдрома, кровоточивость послеоперационных ран до и после акта дефекации.
Результаты оценивали как отличные, очень хорошие, хорошие, посредственные и неудовлетворительные. Отличные результаты: жалоб нет, отсутствие кровотечения, выпадения геморроидальных узлов, болевых ощущений при пальцевом исследовании прямой кишки, осложнений. Очень хорошие результаты: жалоб практически нет, незначительная болезненность при пальцевом исследовании прямой кишки, отсутствие или единичный эпизод кровотечения, отсутствие выпадения узлов, осложнений. Хорошие результаты: жалобы на дискомфорт в области ануса при или после акта дефекации, периодическое выделение крови после дефекации, отсутствие выпадения узлов, осложнений, в анальном канале определяются единичные дефекты слизистой с тенденцией к эпителизации, невыраженные кожные бахромки. Посредственные результаты: жалобы на боли, болезненность при пальцевом исследование прямой кишки, в анальном канале определяются дефекты слизистой оболочки без тенденции к эпителизации, имеют место гипертрофированные анальные бахромки. Неудовлетворительные результаты: развитие послеоперационных осложнений, таких как стриктура, недержание или рецидив заболевания.
Статистическая обработка результатов проводилась с использованием программы «Statistica 6.0».
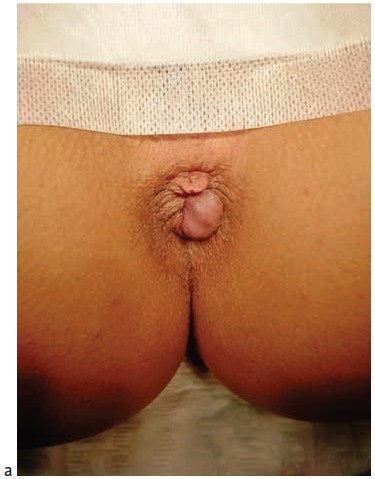
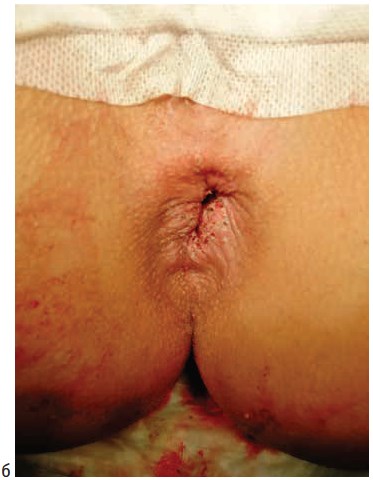
Рисунок 2. Трансдермальная субмукозная лазерная деструкция геморроидальных узлов: а) геморроидальные узлы до вмешательства; б) геморроидальные узлы после вмешательства
Figure 2. Transdermal submucosal laser destruction of hemorrhoid piles a) before procedure; b) after procedure
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При анализе медицинской документации и обработке анкет пациентов установлено, что продолжительность операции при хроническом геморрое составляла от 18 до 22 минут (в среднем, 20,3±1,2 минут).
После лазерной вапоризации гипертрофированной геморроидальной ткани у всех пациентов отмечалось уменьшение размеров геморроидальных узлов в 4 – 5 раз (Рис. 2). Среднее время госпитализации при выполнении подобных операций составляло от 7 до 10 часов (в среднем, 9,1±0,4 часов). 12 больных остались в стационаре на сутки. Во всех случаях причинами явилось настойчивое желание находится под наблюдением медицинского персонала.
Послеоперационный период у большинства пациентов протекал типично. В 41 (33,1%) случае отмечалось появление отечности тканей в зоне лазерного воздействия на третьи сутки после операции. Была отмечена зависимость возникновения отека тканей от объема субмукозно введенного раствора анестетика. Полное разрешение отека наступало к 13-14 суткам послеоперационного периода. У двух пациентов были отмечены эпизоды активного анального кровотечения без гемодинамических нарушений и снижения показателей красной крови. Первый эпизод проявился однократным интенсивным отделением крови после акта дефекации на 7 сутки, второй – на 9 сутки после операции. В последнем случае пациент принимал ранее назначенный в связи с наличием кардиальной патологии антикоагулянт апиксабан.
Максимальная выраженность болевого синдрома у оперированных пациентов с хроническим геморроем (до 5 баллов по шкале ВАШ) наблюдалась на первые и третьи сутки после операции. Далее значения колебались в пределах от 2 до 4 баллов, а полный регресс болевого синдрома отмечался к 19 суткам после оперативного лечения. Длительность приема анальгетиков составляла не более 7 дней (в среднем, 5,0±0,8 дней), у 8 пациентов в раннем послеоперационном периоде однократно были применены наркотические анальгетики (Табл. 2).
Таблица 2. Выраженность болевого синдрома и количество пациентов, которым требовалось назначение анальгетиков в послеоперационном периоде
Table 2. Postoperative intensity of pain and need for analgetics
| Параметры | 1 сутки | 2 сутки | 3 сутки | 4 сутки | 5 сутки | 6 сутки | 7 сутки |
| Выраженность болевого синдрома (баллы) | 4,0±0,5 | 3,4±0,3 | 3,9±0,8 | 3,1±0,4 | 2,8±0,6 | 3,0±0,3 | 2,3±0,2 |
| Потребность в нестероидных противовоспалительных препаратах (абс./проц.) | 115 (92,7%) |
12 (90,3% |
100 (80,6%) |
72 (58,1%) |
32 (25,8%) |
21 (16,9%) |
3 (2,4%) |
| Потребность в наркотических анальгетиках (абс./ проц.) | 8 (6,5%) | – | – | – | – | – | – |
Таблица 3. Динамика клинических проявлений через 4 недели с момента выполнения операции
Table 3. Clinical manifestations 4 weeks after surgery
| Клинические проявления |
II стадия (n=64) | III стадия (n=44) | IV стадия (n=16) | Все пациенты (n=124) |
||||
| До операции | После операции | До операции | После операции | До операции | После операции | До операции | После операции | |
| Рецидивные анальные кровотечения |
30 | 1 | 32 | 1 | 12 | – | 74 (59,7%) | 2 (1,6%) |
| Выпадение геморроидальных узлов | 9 | – | 42 | – | 16 | – | 67 (54,0%) | – |
| Рецидивирующие перианальные тромбозы | 13 | – | 19 | – | 1 | – | 33 (26,6%) | – |
| Эстетический дискомфорт | 30 | 9 | 9 | 8 | 2 | 1 | 41 (33,1%) | 18 (14,5%) |
Период нетрудоспособности колебался от 4 до 6 суток и, в среднем, составлял 5,1±0,3 койко-дней.
При осмотре через 4 недели большинство оперированных пациентов отмечали исчезновение таких симптомов геморроидальной болезни, как анальные кровотечения после акта дефекации (97,3% пациентов) и выпадение геморроидальных узлов (100% пациентов) (Табл. 3). Акт дефекации становился более комфортным, какие-либо болевые ощущения отсутствовали. В эти сроки, при осмотре пациентов, оперированных только с использованием лазера, у 107 (86,3%) отмечена полная эпителизация ран, рубцовой деформации анального канала не выявлено ни у одного пациента. В случаях использования лазера в комбинации с биполярной коагуляцией или ультразвуковым воздействием состояние ран анального канала, в большинстве случаев (82,4%), соответствовало состоянию послеоперационной раны при изолированном применении лазера. У 18 (14,5%) больных имелись остаточные анальные бахромки, не доставляющие какого-либо дискомфорта. У 5 (4,0%) пациентов потребовалось проведение иссечения гипертрофированных бахромок перианальной области. Это было выполнено с помощью монополярного коагулятора под местной анестезией. У 7 (5,6%) пациентов сроки заживления ран анального канала и перианальной области затянулись до двух месяцев.
Клинически это сопровождалось умеренно выраженным болевым синдромом после акта дефекации и появлением кровянистых выделений из анального канала и ран перианальной области после акта дефекации. Полное заживление наступило на фоне проводимой комплексной местной терапии, дополнительного оперативного вмешательства не потребовалось.
Клиническое обследование и данные анкетирования по завершении лечения показали отличные и очень хорошие результаты у 87 (70,2%) больных, хорошие – у 28 (22,6%), посредственные и неудовлетворительные – у 9 (7,2%) (Табл. 4).
Таблица 4. Результаты лечения через 4 недели с момента выполнения операции
Table 4. Results 4 weeks after surger
| Результаты | II стадия (n=64) | III стадия (n=44) | IV стадия (n=16) | Все пациенты (n=124) |
| Отличные | 15 (12,1%) | 9 (7,3%) | 2 (1,6%) | 26 (21,0%) |
| Очень хорошие | 37 (29,8%) | 21 (17,0%) | 3 (2,4%) | 61 (49,2%) |
| Хорошие | 12 (9,7%) | 9 (7,3%) | 7 (5,6%) | 28 (22,6%) |
| Посредственные | - | 4 (3,2%) | 2 (1,6%) | 6 (4,8%) |
| Неудовлетворительные | - | 1 (0,8%) | 2 (1,6%) | 3 (2,4%) |
Отдаленные результаты через 1 год после оперативного вмешательства изучены у 23 больных. Клинических проявлений геморроидальной болезни не было выявлено ни у одного пациента. В одном случае жалобы были обусловлены наличием острой анальной трещины. Пациенту был проведен курс консервативной терапии, достигнут положительный эффект.
Таким образом, субмукозная лазерная деструкция геморроидальных узлов является хорошим дополнением к арсеналу операций, применяемых при лечении хронического геморроя. Она не отличается большой длительностью и позволяет ограничиться пребыванием в стационаре одного дня. Также для нее характерны минимальные сроки периода реабилитации. Что касается результатов в раннем послеоперационном периоде и в сроки до 4 недель после операции, то вмешательство хорошо переносится пациентами, имеет малое количество таких осложнений, как рецидивные анальные кровотечения и выпадения геморроидальных узлов. Большинство пациентов к окончанию наблюдения расценивают свое состояние как хорошее и очень хорошее. Это можно связать с такими эффектами лазерного излучения, как отсутствие выраженной экссудации и лейкоцитарной инфильтрации, что способствует приближенному к физиологическим параметрам ремоделированию тканей в месте лазерного воздействия. Еще одним фактором, способствующим сокращению фаз раневого процесса, является длина волны. Излучение в «водоспецифичном» режиме менее глубоко проникает в ткани, при этом не происходит повреждения глубжележащих тканей и, как следствие, более грубых рубцовых процессов.
ЗАКЛЮЧЕНИЕ
Наш опыт выполнения субмукозной лазерной деструкции геморроидальных узлов с использованием «водоспецифичного» лазера при лечении больных с хроническим геморроем показал, что данная методика позволяет ускорить сроки реабилитации пациентов за счет снижения уровня боли и минимизации количества послеоперационных осложнений.
Однако, для более объективной оценки эффективности метода необходимо дальнейшее проведение сравнительных исследований как с традиционными хирургическими вмешательствами, так и изучение влияния на процессы заживления излучения с различной длиной волны.
Авторы заявляют об отсутствии конфликта интересов
The authors declare no conflicts of interest
ЛИТЕРАТУРА
- De Nardi P, Tamburini AM, Gazzetta PG. et al. Hemorrhoid laser procedure for second- and third-degree hemorrhoids: results from a multicenter prospective study. Tech. Coloproctol. 2016; 20 (7): 455-459. DOI: 10.1007/s10151-016-1479-6.
- Plapler H, Hage R, Duarte J. et al. A new method for hemorrhoid surgery: intrahemorrhoidal diode laser, does it work? Photomed Laser Surg. 2009; 27 (5): 819-823. DOI: 10.1089/pho.2008.2368.
- Hodgson WJ, Morgan J. Ambulatory hemorrhoidectomy with CO2 laser. Dis Colon Rectum. 1995; 38 (12): 1265-1269. DOI: 10.1007/ bf02049150.
- Maloku H, Gashi Z, Lazovic R. et al. Laser hemorrhoidoplasty procedure vs open surgical hemorrhoidectomy: a trial comparing 2 treatments for hemorrhoids of third and fourth degree. Acta Inform Med. 2014; 22 (6): 365-367. DOI: 10.5455/aim.2014.22.365-367.
- Плетнев С.Д. Лазеры в клинической практике. Руководство для врачей. М.: Медицина, 1996. 432 с.
- Скобелкин О.К. Лазеры в хирургии. М.: Медицина, 1989. 256 с.
- Гаин М.Ю., Шахрай С.В. Малоинвазивные технологии в комплексном лечении геморроя. Новости хирургии. 2011; т. 19, № 4, с. 113-122.
- Родоман Г.В., Корнев Л.В., Шалаева Т.И. и соавт. Эффективность комбинированной методики лечения геморроя с использованием HAL-RAR и лазерной деструкции узлов. Хирургия. 2017; № 5, с. 47-51. DOI: 10.17116/hirurgia2017547-51.
- Goldman MP, Detwiler SP. Endovenous 1064-nm and 1320-nm Nd:YAG laser treatment of the porcine greater saphenous vein. Cosmetic Dermatology. 2003; 16 (2): 25-28.
- Naderan M, Shoar S, Nazari M. et al. A randomized controlled trial comparing laser intra-hemorrhoidal coagulation and Milligan-Morgan hemorrhoidectomy. J Invest Surg. 2017; 30 (5): 325-331. DOI: 10.1080/08941939.2016.1248304.
- Proebstle TM, Moehler T, Gül D. et al. Endovenous treatment of the great saphenous vein using a 1,320 nm Nd: YAG laser causes fewer side effects than using a 940 nm diode laser. Dermatol Surg. 2005; 31 (12): 1678-1683.
- Weyand G, Theis CS, Fofana AN, R üdiger F, et al. Laserhämorrhoidoplastie mit dem 1470-nm-diodenlaser in der behandlung des zweit-bis viertgradigen hämorrhoidalleidens – eine kohortenstudie mit 497 fällen. Zentralbl Chir. 2017; 144 (4): 355-363. DOI: 10.1055/s-0043-120449.
Статья опубликована в журнале "Колопроктология" №2 2020, стр. 104-112

