Значение особенностей структуры и метаболизма внеклеточного матрикса в патогенезе грыж брюшной стенки. Обзор литературы

Кубышкин В.А., Галлямов Э.А., Агапов М.А., Какоткин В.В., Давлятов М.Р.
Московский государственный университет имени М.В. Ломоносова, факультет фундаментальной медицины (МГУ имени М.В. Ломоносова), ул. Ленинские Горы, д. 1, 119991, Москва, Российская Федерация
Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет), Большая Пироговская ул., д. 19 стр. 1, 119146, Москва, Российская Федерации
Введение
На сегодняшний день вентральные грыжи повсеместно сохраняют за собой позицию одной из самых частых причин плановых и экстренных оперативных вмешательств. Только в США среднегодовые затраты на лечение грыж достигают 3 миллиардов долларов [1 ] . Несмотря на широкое распространение различных методик устранения грыжевого дефекта, включая популярные в последние годы традиционные ненатяжные и лапароскопические способы, проблема рецидивных грыж не утратила своей актуальности. Частота ранних рецидивов в первые годы после выполнения герниопластики колеблется в пределах от 1 , 7 % до 3 , 4 % [2 ] . По данным шведского регистра грыж, содержащего данные более 1 5 0 0 0 0 пациентов, не менее 9 % от ежегодно выполняемых герниопластик приходится на рецидивные грыжи [3 ] recurrent groin hernias where several repairs have previously been undertaken constitutes a major problem in hernia surgery. Low numbers and heterogeneity have made it difficult to perform large prospective studies on this group. METHODS The study was designed as an observational population-based register study. All repairs for recurrent hernia recorded in the Swedish Hernia Register (SHR. Если в начале 9 0 -х годов прошлого века на долю рецидивных грыж приходилось 1 6 .4 % герниопластик ежегодно выполняемых в Швеции, то к 2 0 0 8 году их доля составила 9 . 3 % [4 ] . Несомненно, обращает на себя внимание и тот факт, что любое вмешательство с использованием лапаротомного доступа также несёт в себе риск развития грыжи. Так, по данным датского регистра грыж, после плановой или неотложной лапаротомии послеоперационные грыжи возникают у четверти пациентов в течение 4 3 месяцев, а у лиц с дополнительными факторами риска (ожирение, сахарный диабет, хроническая обструктивная болезнь легких, нарушения обмена соединительной ткани и др.) послеоперационные грыжи возникают почти в половине случаев. При развитии инфекционных осложнений послеоперационной раны, по данным последних обзоров литературы, риск развития послеоперационной грыжи увеличивается вдвое [5 – 7 ] . Ставшие классическими представления о ведущей роли повышенного внутрибрюшного давления (длительный кашель, тяжелые физические нагрузки, беременности, гиперплазия простаты, запоры и др.) как производящего фактора в развитии грыж не всегда находят подтверждение в истории заболевания и не до конца объясняют механизм его возникновения. Более новые представления о развитии грыж брюшной стенки предполагают многокомпонентность вовлеченных этиопатогенетических факторов. Так, по данным F. Charles Brunicardi, косые паховые грыжи развиваются менее чем у половины лиц с незаращенным влагалищным отростком брюшины [8 ] . Следовательно, анатомический дефект брюшной стенки в так называемом «слабом месте» брюшной стенки не является достаточным фактором для возникновения паховой грыжи. Еще в начале 7 0 -х годов прошлого века это отметили Wagh и соавторы [9], которые на основании данных электронной микроскопии и комплексных исследований химического состава коллагеновых волоконизинтраоперационных биоптатов переднего листка влагалища прямых мышц живота показали,что у пациентов с паховыми грыжами по сравнению с пациентами, прооперированными по другим причинам, наблюдаются выраженные количественные и качественные изменения белков семейства коллагенов. Это,в свою очередь, послужило причиной возникновения повышенного интереса к тонким молекулярным процессам метаболизма соединительной ткани и архитектонике экстра-целлюлярного матрикса у пациентов с так называемой грыжевой болезнью и другими близкими по патогенезу развития заболеваниями,а также физиологии заживления раны и механизму формирования операционного рубца.
Целью работы являлся анализ современных представлений о роли процессов метаболизма соединительной ткани и индивидуальных особенностей строения экстрацеллюлярного матрикса в патогенезе вентральных грыж в целях выявления ключевых точек, которые позволят в будущем разработать персонализированный подход к лечению пациентов данной группы.
Материалы и методы
Поиск литературы осуществлялся в информационных системах и базах данных Cochrane Library, PubMed, UpToDate, Google Scholar и eLIBRARY. Запросы в PubMed выполнялись с использованием MeSH (Medical Subject Heading) терминов: hernia, incisional hernia, recurrent hernia, etiology, connective tissue/abnormalities, connective tissue/metabolism, collagen/metabolism, collagen/structure, wound healing, abdominal wound closure techniques и др. Также были выставлены следующие фильтры: год публикации не позднее 1 9 9 0 г и язык публикации (русский, английский). Поиск литературы также осуществлялся в библиографических списках отобранных публикаций
Результаты
Первичным результатом поиска являлись 1 6 0 4 публикации, применение фильтров позволило сократить количество публикаций до 9 7 8 . После анализа названий и кратких сведений публикаций для дальнейшего изучения были отобраны 1 8 4 публикации. По итогам анализа абстрактов этих публикаций полнотекстовые версии 4 4 из них были подробно изучены. В обзор литературы были включены 3 6 статей.
Биологические аспекты строения и обмена соединительной ткани
Ключевым компонентом практически любого типа соединительной ткани является коллаген. Массовая доля его в фасциально-апоневротических слоях брюшной стенки достигает 8 0 % [1 0 ,1 1 ]. По этой причине количественные и качественные изменения состава коллагена, очевидно играют важную роль в развитии грыжевой болезни. Коллаген по своей структуре является фибриллярным белком, пространственная конфигурация которого в соединительной ткани представлена в виде волокон, образованных путём формирования ковалентных связей между отдельными коллагеновыми белками разных типов. На сегодняшний день выделяют более 2 0 типов коллагеновых белков. Однако, в рамках грыжевой болезни, интерес представляют лишь коллагеновые белки I, III, IV и V типов. Фибриллы коллагеновых белков I, III и V типов образуют коллагеновые волокна соединительной ткани, представленной в фасциально-апоневротических слоях брюшной стенки. Коллаген I типа является самым механически устойчивым типом коллагена, на его долю приходится 9 0 % объёма коллагеновых волокон фасциальных слоёв брюшной стенки. Коллаген III типа является важным компонентом ретикулярной соединительной ткани и, как правило, формирует волокна в сочетании с коллагеном I типа. Коллаген V типа, также называемый малым фибриллярным коллагеном, играет принципиальную роль на первых этапах формирования коллагеновых волокон. Коллаген же IV типа является опорным компонентом базальных мембран, кроме того, доказана важная роль коллагена IV типа в процессах формирования фиброзной ткани [7 , 8 , 1 2 ]. Гомеостаз соединительной ткани характеризуется тонким балансом процессов синтеза и деградации компонентов соединительной ткани. Относительную активность этих процессов можно оценить посредством определения в крови специфических продуктов обмена коллагена, которые называются нео-эпитопами. Нео-эпитопы представляют собой специфичные для коллагенов разных типов последовательности полипептидов, возникающие в процессе их синтеза в качестве побочных продуктов, а также при их ферментативном расщеплении матриксными металлопротеиназами (ММР) [1 2 ,1 3 ]neo-epitopes. Neo-epitopes are post-translational modifications (PTMs. Таким образом, для каждого типа коллагена существуют некоторые специфичные маркеры, позволяющие провести количественную оценку степени вовлеченности этого белка в синтетические и деструктивные процессы
Биологические аспекты слабости соединительной ткани
Дальнейшее изучение количественного и качественного состава соединительной ткани у грыженосителей привело к открытию ряда патофизиологических и патоморфологических изменений соединительной ткани, различные сочетания которых часто встречаются у пациентов с вентральными грыжами. Наиболее изученным патоморфологическим изменением, ассоциированным с грыжевой болезнью, является уменьшение соотношения коллагенов I и III типов, которое приводит к уменьшению диаметра коллагеновых волокон и снижению ее механической резистентности, а это в свою очередь приводит к слабости фасциальных слоёв брюшной стенки [7 , 1 4 –1 6 ].
В основе другого механизма структурных нарушений коллагеновых волокон лежит снижение гидроксилирования остатков пролена и лизина на внутриклеточном этапе синтеза коллагена. Образующиеся в результате этих реакций гидроксипролен и гидроксилизин участвуют в формировании перекрестных связей, стабилизирующих структуру коллагеновых фибрилл. Подобными последствиями сопровождаются нарушения активности фермента лизил-оксидазы на внеклеточном этапе синтеза коллагена. Следовательно, нарушение гидроксилирования остатков пролена и лизина на внутриклеточном этапе синтеза коллагена, либо снижение ферментативной активности лизил-оксидазы в эктроцеллюлярной фазе синтеза коллагена приводят к формированию дефектного коллагена [1 4 ]. В одном из исследований было обнаружено значительное снижение концентрации меди (которая является коферментом лизил-оксидазы) в плазме пациентов с прямыми грыжами по сравнению с пациентами с косыми грыжами и контрольной группой не имеющей грыж [1 7 ].
Ещё одной возможной причиной слабости соединительной ткани является повышенная активность ферментов, участвующих в деградации коллагена. Деградация коллагена осуществляется матриксными металлопротеазами (MMP). Так повышенная экспрессия изофермента ММР-2 была выявлена у пациентов с прямыми грыжами, а экспрессия ММЗ- 1 3 была повышена у пациентов с рецидивными грыжами [1 4 ,1 8 ]. Также в одном из исследований уровень ингибитора ММР-2 был значительно снижен у пациентов с прямыми грыжами по сравнению с пациентами с косыми грыжами и контрольной группой [1 9 ]. Кроме того, исследования показали что экспрессия изоферментов MMP-2 и MMP-9 повышается с возрастом [1 4 ]. Возможно именно с этим феноменом связано наблюдение Абрамсона, который ещё в 1 9 7 8 году показал, что вероятность развития паховой грыжи у мужчин в значительной степени зависит от возраста. [2 0 ]. Следует отметить, что все эти исследования носили обсервационный характер и в них оценивался уровень экспрессии фермента, а не его ферментативной активности. Следует отметить, что, несмотря на возможный системный характер повышения уровня экспрессии ММР, нельзя с уверенностью утверждать, что повышенная экспрессия ММР является причиной развития грыжевой болезни, поскольку, учитывая данные о возможном влиянии механических факторов на активность фибробластов, вполне возможно, что развитие грыж приводит к вторичному повышению экспрессии ММР.
Обращает на себя внимание интересное клиническое исследование, целью которого было оценить уровень продуктов метаболизма соединительных тканей у пациентов трех групп: с односторонними паховыми грыжами, с множественными вентральными грыжами и послеоперационными вентральными грыжами (ПОВГ) [2 1 ]. На основании анализа концентрации промежуточных продуктов метаболизма межклеточного матрикса у 8 1 пациента было выявлено, что уровень P4 N P (терминальный пропептид проколлагена IV типа, маркер активности метаболизма волокнистой и костной соединительных тканей) и С3 M (маркер ММРзависимой деградации коллагена III типа) значительно отличался у представителей контрольной группы, что позволяет сделать предварительные выводы о возможности использования данного молекулярного маркера в качестве предиктора высокого развития у пациента не только возраст – ассоциированных грыжевых выпячиваний, но и ПОВГ. В то же время, снижение маркеров синтеза коллагена I и III типа в сыворотке больных, соответствующее подобным изменениям в соединительной ткани, выявленных при гистологическом исследовании, не было столь выражено, как увеличение синтеза IV типа коллагена. Это открытие может быть ключом к формированию нового подхода к профилактике и лечению грыж.
Изучение активности обмена коллагеновых волокон путём количественной оценки их серологических маркеров, показало значительное увеличение обмена коллагена IV типа и значительное снижение обмена коллагена V типа у грыженосителей [7 ] . При этом значимость снижения обмена коллагена V типа в патогенезе слабости соединительной ткани, вероятно, связана с его важной ролью в формировании зрелых коллагеновых волокон [2 2 ]. Известно, что мутации коллагенов I и V типов манифестируют классическим вариантом течения синдрома Элерса-Данлоса [2 3 ]. Значимость усиления обмена коллагена IV типа в патогенезе слабости соединительной ткани остаётся непонятной. Однако, известно, что обмен коллагена IV типа повышается при развитии фиброзных процессов, которые, в свою очередь, характерны для тканей окружающей грыжевой мешок [7 ] . Поэтому, вполне возможно, что повышенный уровень обмена коллагена IV типа является не причиной, а следствием развития грыж.
Биологические аспекты заживления послеоперационной раны и слабости послеоперационного рубца
Механизм заживления операционной раны представляет собой сложный процесс, в регуляции которого принимают участие множество клеточных, гуморальных и молекулярных факторов, активирующихся в момент повреждения тканей. В процессе заживления послеоперационной раны выделяют несколько фаз, характеризующихся различными надмолекулярными и биохимическими процессами: гемостаз, воспаление, пролиферация (формирование грубого рубца) и созревание (ремоделирование рубца) [8 ] .Отклонения в любой из фаз заживления раны способны приводить к развитию послеоперационной или рецидивной вентральной грыжи. Метаболический диссонанс в матриксе соединительной ткани при заживлении раны представлен на Рис.1 .
Как видно, в процессе заживления послеоперационных ран наблюдаются характерные изменения состава коллагеновых волокон, которые определяют механическую устойчивость послеоперационного рубца. На ранних стадиях заживления раны для коллагеновых волокон характерно высокое содержание фибрилл коллагена III типа, на долю которого в первые дни заживления раны приходится до 8 0 % фибрилл, составляющих коллагеновые волокна. В тоже время, устойчивость послеоперационного рубца к механическому воздействию в первую неделю после операции составляет менее 5 % по сравнению с нормальными одноименными тканями. В последующем эти волокна замещаются волокнами с высоким содержанием коллагена I типа, которые характерны для зрелой рубцовой ткани. Зрелая рубцовая ткань формируется примерно к 7 0 -м суткам после операции [8 ] . Однако, механическая устойчивость зрелой рубцовой ткани даже при самом благоприятном исходе не может превышать 8 0 -9 0 % одноименной здоровой ткани. Следует отметить, что для удовлетворительной повседневной активности достаточно 1 5 -2 0 % механической прочности, свойственной для здоровых тканей [6 ] . Таким образом, состоятельность послеоперационной раны в течение первой недели после операции находится в прямой зависимости от механических характеристик наложенных швов. Более того, наложенные швы оказывают влияние на процесс заживления раны, при этом значение имеют как техника наложения шва, так и характеристики используемого шовный материал. Это было показано сначала в экспериментальных исследованиях, а потом и в рандомизированных клинических исследованиях и метаанализах [2 4 –2 9 ].
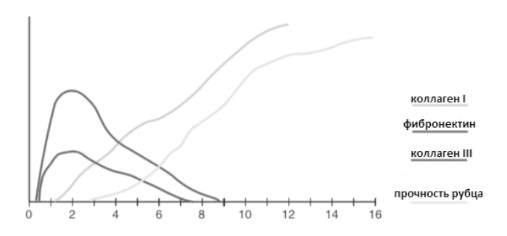
Рис.1. Изменение количественного состава внеклеточного матрикса и прочности сформированного рубца в процессе заживления раны. По оси абсцисс – время с момента нанесения раны (дни). По оси ординат – относительные концентрации компонентов межклеточного матрикса. Адаптировано из Schwartz’s Principles of Surgery (11th Ed.). The McGraw Hill Companies, Inc., 2019
Обсуждение
Большая часть авторов в своих исследованиях уделяют внимание снижение соотношения коллагенов I и III типов в волокнах фасциально-апоневротических слоёв брюшной стенки грыженосителей, объясняя это отражением системных нарушений метаболизма коллагена. Например, Peeters E, DeHertogh G и Junge K сравнили соотношение коллагенов I/III типов у пациентов с первичными паховыми, рецидивными паховыми, послеоперационными и рецидивными послеоперационными грыжами с таковым у здоровых лиц контрольной группы. Было выявлено, что у пациентов с грыжами брюшной стенки соотношение коллагенов I и III типов было значительно ниже по сравнению с контрольной группой. Кроме того, у пациентов с рецидивными грыжами это соотношение было еще более низким в сравнении с пациентами с первичными грыжами. Также была установлена прямая и сильная корреляция между соотношением коллагенов I/III типов в подкожной жировой клетчатке и в переднем листке влагалища прямых мышц живота, что может говорить о системности патологических изменений соединительной ткани [3 0 ]. Henriksen NA и соавторы показали, что нарушения количественного и качественного состава соединительной ткани несколько отличаются у пациентов с грыжевыми дефектами разных локализаций. В частности, менее выраженные нарушения отмечаются у пациентов с косыми паховыми грыжами в сравнении с пациентами с прямыми паховыми грыжами [1 4 ]. Так в исследовании типа “случай-контроль” Antonio Britto Casanova и соавторы выявили, что у пациентов с прямыми грыжами содержание коллагена I типа в поперечной фасции было на 2 3 .7 % меньше чем у здоровых лиц контрольной группы. В то время как содержание коллагена III типа в поперечной фасции было на 6 . 4 % меньше в здоровой контрольной группе (p < 0 . 0 1 ) [3 1 ]. В исследовании Klinge U и соавторов показано, что у пациентов с послеоперационными вентральными грыжами, по сравнению с контрольной группой, также наблюдается снижение соотношения коллагенов I / III типов. В связи с этим ключевая роль в развитии послеоперационных вентральных грыж была отведена увеличению количества коллагена III типа в рубцовой ткани [3 2 ]. На формирование послеоперационного рубца, как было отмечено раннее, влияют множество факторов. Наибольшее практическое значение в хирургической практике имеют корригируемые факторы, такие как техника ушивания послеоперационной раны и выбор шовного материала [6 ].
Поиск эффективных методов ушивания послеоперационных ран являются предметом научных изысканий с момента зарождения полостной хирургии, однако частота развития послеоперационных грыж остаётся стабильно высокой на сегодняшний день. В связи с этим, в последние годы заметно увеличилось количество работ по изучению тонких механизмов заживления послеоперационных ран, а также влияния технических аспектов ушивания послеоперационной раны на процесс заживления и формирование послеоперационного рубца [6 , 8 ] . Установлено, что степень активности и длительность воспалительных процессов во время заживления непосредственно влияют на состав коллагеновых волокон, формирующих послеоперационный рубец. Например, увеличение длительности и степени активности воспалительной фазы заживления ассоциировано с увеличением количества коллагена III типа в послеоперационном рубце [3 3 ]. Многочисленные экспериментальные исследования показали, что ушивание послеоперационной раны отдельными узловыми швами, а также непрерывным швом с сильным натяжением ассоциированы с ишемией и некрозом краёв раны, которые значительно усиливают и удлиняют воспалительную фазу заживления, приводя к формированию рубца с высоким содержанием коллагена III типа и тем самым увеличивают риск развития послеоперационной грыжи [6 , 2 9 ,3 3 ]. Это было подтверждено и в клинических исследованиях [2 5 –2 7 ] Кроме того, при сравнении послойного ушивания (отдельно париетальную брюшину, отдельно мышечно-апоневротические структуры и подкожную клетчатку) с так называемой «mass closure», заключающейся в ушивании всех слоев брюшной стенки (за исключением кожи) единым блоком, последние были ассоциированы с меньшей частотой послеоперационных грыж [6 , 2 9 ]. Исходя из имеющейся доказательной базы, оптимальный способ ушивания послеоперационной раны – это ушивание едиными блоком всех слоев используя непрерывный медленно рассасывающийся шов (PDS, MonoPlus, Maxon) с умеренным натяжением нити и соотношением длины нити к длине раны более 4 : 1 [6 ] . Таким образом биологический механизм развития грыж брюшной стенки в большинстве случаев предполагает наличие первичной патологии фасциально-апоневротических слоёв брюшной стенки, либо нарушение заживления послеоперационной раны. При этом в патогенезе большинства послеоперационных грыж, вероятнее всего, в большинстве случаев, имеет место именно дефект техники ушивания послеоперационной раны, в то время как в патогенезе рецидивных грыж, вероятнее всего, имеет место комбинация этих факторов.
В повседневной практике мы практически не учитываем биологические детерминанты развития грыжи или грыжевой болезни, хотя часто наблюдаем малые признаки системной дисплазии соединительной ткани. Предпринятые в последние годы попытки выявления серологических маркеров, позволяющих предсказать развитие контралатеральных, рецидивных или послеоперационных грыж, не увенчались успехом [7 , 1 2 ]. На сегодняшний день прогностическая значимость описанных маркеров находится под большим вопросом и требует дальнейших исследований. Наличие подобного инструмента в арсенале хирурга привело бы к значительным изменениям тактики ведения и лечения не только установленных грыженосителей, но и пациентов с другими заболеваниями, имеющими высокий риск развития послеоперационных грыж. Так значительный интерес представляет профилактическое укрепление послеоперационной раны сетчатым аллотрансплантатом при открытых плановых оперативных вмешательствах у пациентов с высоким риском развития послеоперационных вентральных грыж (пациенты с ожирением, диастазом прямых мышц живота и аксиальными грыжами, пациенты с аневризмой брюшного отдела аорты и др.) [3 4 ,3 5 ]. Однако в связи с отсутствием убедительных данных о возможности и частоте развития потенциальных осложнениях, ассоциированных как с сетчатым имплантом, так и с самой профилактической аллопластикой в раннем и позднем послеоперационном периоде, выполнение профилактической аллопластики у этих пациентов на сегодняшний день не может быть рекомендовано [5 , 6 ].
Выводы
На сегодняшний день проведено и проанализировано значительное число экспериментальных и клинических исследований, направленных на изучение тонкой архитектоники и состава экстрацеллюлярного матрикса у пациентов с грыжами брюшной стенки. Однако в ряде случаев эти работы имеют в достаточной степени противоречивые результаты. Так, при анализе различных предложенных молекулярных маркеров метаболизма соединительной ткани, наблюдаемые у грыженосителей протеомические паттерны не нашли отражения в виде значительных количественных и качественных изменений обмена коллагенов соответствующих типов. Более того, индивидуальные морфологические особенности, характерные для грыж разных локализаций, также не нашли отражения в изменениях уровня серологических маркеров [7 , 1 2 ]. Большая часть научных работ по изучению индивидуальных особенностей коллагенового обмена у пациентов с грыжами передней брюшной стенки имеют ряд недостатков. Так контрольные группы в большинстве работ не репрезентативны (поскольку, в теории, пациенты контрольной группы, не имеющие на момент исследования грыжевых дефектов, в будущем могут стать грыженосителями). Обращает на себя внимание тот факт, что в ряде исследований количественный и качественный анализ компонентов соединительной ткани в основной и контрольной группах проводился на образцах из неоднородных видов тканей, что ставит под сомнение результаты этих исследований, поскольку неизвестно, какой вид соединительной ткани наиболее репрезентативен при изучении структурных нарушений коллагеновых волокон.
Несмотря на вполне успешные исследования, направленные на количественный и качественный анализ структуры соединительной ткани пораженных тканей у больных, до сих пор нет каких-либо убедительных данных, подтверждающих или опровергающих наличие корелляции между индивидуальными особенностями структуры соединительной ткани, концентрацией продуктов деградации экстрацеллюлярного матрикса и клиническими характеристиками течения того или иного заболевания у разных групп пациентов.
Мультифакторность развития грыж брюшной стенки и отсутствие возможности в подавляющем большинстве случаев выделить ключевое звено патогенеза, которое могло бы быть точкой приложения направленных средств первичной и вторичной профилактики формирования грыжевых дефектов брюшной стенки делает актуальным развитие и широкое внедрение единых техник ушивания брюшной стенки, а также лапароскопических вмешательств при грыжах брюшной стенки, поскольку последние имеют некоторые теоретические преимущества у пациентов с предполагаемой «слабостью соединительной ткани» [3 , 4 , 3 6 ].
Список литературы
- Rutkow I.M. Demographic and socioeconomic a spects of hernia repair in the United States in 2003. Surg Clin North Am. 2003 Octб 83(5)б pp. 1045-51, v-vi. [ https://doi.org/ 10.1016/S0039-6109(03)00132-4]
- Yang B, Zhou S, Li Y, Tan J, Chen S, Han F. A comparison of outcomes between lichtenstein and laparoscopic transabdominal preperitoneal hernioplasty for recurrent inguinal hernia. Am Surg. 2018 Nov 1, 84(11), pp. 1774-1780.
- Sevonius D, Gunnarsson U, Nordin P, Nilsson E, Sandblom G. Repeated Groin Hernia Recurrences. Ann Surg. 2009 Mar, 249(3), pp. 516-8. [ https://doi.org/ 10.1097/SLA.0b013e318199f21c]
- Sevonius D, Gunnarsson U, Nordin P, Nilsson E, Sandblom G. Recurrent groin hernia surgery. Br J Surg. 2011 Oct, 98(10), pp. 1489-94. [ https://doi.org/ 10.1002/bjs.7559]
- David C Brooks, Michael Rosen W.C. Clinical features, diagnosis, and prevention of incisional hernias. UpToDate. 2019, pp. 1–16.
- Jason S Mizell, Wenliang Chen, Michael Rosen. Principles of abdominal wall closure . UpToDate. 2019. pp. 1-12.
- Henriksen NA, Mortensen JH, Lorentzen L, Agren MS, Bay-Jensen AC, Jorgensen LN et al. Abdominal wall hernias—A local manifestation of systemically impaired quality of the extracellular matrix. Surgery. 2016 Jul, 160(1), pp. 220-227. DOI: 10.1016/j.surg.2016.02.011.
- Munier Nazzal, Mohamed F. Osman, Heitham Albeshri, Darren B. Abbas and C.A.A. Schwartz’s Principles of Surgery. Chapter 9: Wound healing . 11th edition. Und. red. F. Charles Brunicardi. McGraw-Hill Education, 2019. 271–299 p.
- Wagh PV, Leverich AP, Sun CN, White HJ, Read RC. Direct inguinal herniation in men: A disease of collagen. J Surg Res. 1974 Dec, 17(6), pp. 425-33.
- Franz M.G. The Biology of Hernia Formation. Surg Clin North Am. 2008 Feb, 88(1), pp. 1-15, vii. [ https :// doi . org / 10.1016/j.suc.2007.10.007]
- Franz M.G. The biology of hernias a nd the abdominal wall. Hernia. 2006 Dec, 10(6), pp. 462-71. [ https://doi.org/ 10.1007/s10029-006-0144-9]
- Henriksen NA, Mortensen JH, Sorensen LT, Bay-Jensen AC, Agren MS, Jorgensen LN et al. The collagen turnover profile is altered in patients with inguinal and incisional hernia. Surgery. 2015 Feb, 157(2), pp. 312-21. [ https://doi.org/ 10.1016/j.surg.2014.09.006]
- Karsdal MA, Henriksen K, Leeming DJ, Woodworth T, Vassiliadis E, Bay-Jensen AC. Novel combinations of Post-Translational Modification (PTM) neo-epitopes provide tissue-specific biochemical markers--are they the cause or the consequence of the disease? Clin Biochem. 2010 Jul, 43(10-11), pp. 793-804. [ https://doi.org/ 10.1016/j.clinbiochem.2010.03.015]
- Henriksen NA, Yadete DH, Sorensen LT, Agren MS, Jorgensen LN. Connective tissue alteration in abdominal wall hernia. Br J Surg. 2011 Feb, 98(2), pp. 210-9. [ https :// doi . org / 10.1002/bjs.7339]
- Rosch R, Klinge U, Si Z, Junge K, Klosterhalfen B, Schumpelick V. A role for the c ollagen I/III and MMP-1/-13 genes in primary inguinal hernia? BMC Med Genet. 2002, 3, p. 2.
- Критерии прогнозирования грыжевой болезни / Иванов С.В., Иванов В.П., Иванов И.С, Барт И.И. // Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. 2013. Т. 8. No 1. С. 77–81.
- Kayaoglu H.A., Hazinedaroglu SM, Bulent Erkek A, Kocaturk PA, Kavas GO, Aribal D. Comparison of the Plasma and Hernia Sac Tissue Copper Levels in Direct and Indirect Inguinal Hernia Patients. Biol Trace Elem Res. 2005 Winter, 108(1-3), pp. 53-9.
- Aren A , Gokce AH, Gokce FS, Dursun N. Roles of matrix metalloproteinases in the etiology of inguinal hernia. Hernia. 2011 Dec, 15(6), pp. 667-71. DOI: 10.1007/s10029-011-0846-5.
- Abci I., Bilgi S., Altan A. Role of TIMP-2 in fascia transversalis on development of inguinal hernias. J Invest Surg. 2005 May-Jun, 18(3), pp. 123-8. [ https :// doi . org / 10.1080/08941930590956147]
- Abramson J.H.. Hopp C, Epstein LM. The epidemiology of inguinal hernia. A survey in western Jerusalem. J Epidemiol Community Health. 1981 Sep, 35(3), pp. 213-7. [ https :// doi . org / 10.1136/jech.35.3.213]
- Taniguchi S, Ueda K, Inoue T, Li TS, Kuga T, Hamano K. Impact of collagen subtype proportions in peritoneal tissues on inguinal hernia formation in adults and infants. Pediatr Surg Int. 2006 Jul, 22(7), pp. 600-4. [ https :// doi . org /10.1007/s00383-006-1701-0]
- Wenstrup R.J.. Florer JB, Brunskill EW, Bell SM, Chervoneva I, Birk DE. Type V collagen controls the initiation of collagen fibril assembly. J Biol Chem. 2004 Dec 17, 279(51), pp. 53331-7. [ https://doi.org/ 10.1074/jbc. M409622200]
- Byers P.H., Murray M.L. Heritable Collagen Disorders: The Paradigm of the Ehlers—Danlos Syndrome . J Invest Dermatol. 2012 Nov 15, 132(E1), pp. E6-11. [ https://doi.org/ 10.1038/skinbio.2012.3]
- Muysoms F.E., Antoniou SA, Bury K, Campanelli G, Conze J, Cuccurullo D et al. European Hernia Society. European Hernia Society guidelines on the closure of abdominal wall incisions. Hernia. 2015 Feb, 19(1), pp. 1-24. [ https://doi.org/ 10.1007/s10029-014-1342-5]
- Millbourn D., Cengiz Y., Israelsson L.A. Effect of stitch length on wound complications after closure of midline incisions: a randomized controlled trial. Arch Surg. 2009 Nov, 144(11), pp. 1056-9. [ https://doi. org/ 10.1001/archsurg.2009.189]
- O’Dwyer P.J., Courtney C.A. Factors involved in abdominal wall closure and subsequent incisional hernia. Surgeon. 2003 Feb, 1(1), pp. 17- 22.
- Patel SV, Paskar DD, Nelson RL, Vedula SS, Steele SR. Closure methods for laparotomy incisions for preventing incisional hernias and other wound complications. Cochrane Database Syst Rev. 2017 Nov 3, 11, CD005661. [ https://doi.org/ 10.1002/14651858.CD005661.pub2]
- Henriksen N.A., Deerenberg EB, Venclauskas L, Fortelny RH, Miserez M, Muysoms FE. Meta-analysis on Materials and Techniques for Laparotomy Closure: The MATCH Review. World J Surg. 2018 Jun, 42(6), pp. 1666-1678. [ https://doi.org/ 10.1007/s00268-017-4393-9]
- Cengiz Y., Gislason H, Svanes K, Israelsson LA. Mass closure technique: an experimental study on separation of wound edge. Eur J Surg. 2001 Jan, 167(1), pp. 60-3. [ https://doi.org/ 10.1080/110241501750069846]
- Peeters E., De Hertogh G, Junge K, Klinge U, Miserez M. Skin as marker for collagen type I/III ratio in abdominal wall fascia. Hernia. 2014 Aug, 18(4), pp. 519-25. [ https://doi.org/ 0.1007/s10029-013- 1128-1]
- Casanova A.B., Trindade E.N., Trindade M.R. Collagen in the transversalis fascia of patients with indirect inguinal hernia: a case-control study. Am J Surg. 2009 Jul, 198(1), pp. 1-5. [ https://doi.org/ 10.1016/j.amjsurg.2008.07.021
- Klinge U., Binnebosel M., Mertens P.R. Are collagens the culprits in the development of incisional and inguinal hernia disease? Hernia. 2006 Dec, 10(6), pp. 472-7. [ https://doi.org/ 10.1007/s10029-006-0145-8]
- Hoer J.J., Junge K, Schachtrupp A, Klinge U, Schumpelick V. Influence of laparotomy closure technique on collagen synthesis in the incisional region. Hernia. 2002 Sep, 6(3), pp. 93-8. [ https://doi.org/ 10.1007/s10029- 002-0070-4]
- Borab Z.M., Shakir S, Lanni MA, Tecce MG, MacDonald J, Hope WW et al. Does prophylactic mesh placement in elective, midline laparotomy reduce the incidence of incisional hernia? A systematic review and meta-analysis. Surgery. 2017 Apr, 161(4), pp. 1149-1163. [ https://doi. org/ 10.1016/j.surg.2016.09.036]
- Bhangu A, Fitzgerald JE, Singh P, Battersby N, Marriott P, Pinkney T. Systematic review and meta-analysis of prophylactic mesh placement for prevention of incisional hernia following midline laparotomy. Hernia. 2013 Aug, 17(4), pp. 445-55. [ https://doi.org/ 10.1007/s10029-013-1119-2]
- Bisgaard T., Bay-Nielsen M., Kehlet H. Re-recurrence After Operation for Recurrent Inguinal Hernia. A Nationwide 8-Year Follow-up Study on the Role of Type of Repair. Ann Surg. 2008 Apr, 247(4), pp. 707-11. [ https :// doi . org / 10.1097/SLA.0b013e31816b18e3]
Статья опубликована в журнале "Хирургическая практика" № 1(41) 2020

